Índice:
- 1 Historia de la termodinámica
- 2 Leyes de la termodinámica
- 3 Equilibrio térmico
- 4 Procesos termodinámicos
- 5 Rendimiento termodinámico o eficiencia
- 6 Diagramas termodinámicos
- 7 transformaciones
- 8 conclucines
- 9 bibliografia
- 1 Historia de la termodinámica
- 2 Leyes de la termodinámica
- 3 Equilibrio térmico
- 4 Procesos termodinámicos
- 5 Rendimiento termodinámico o eficiencia
- 6 Diagramas termodinámicos
- 7 transformaciones
- 8 conclucines
- 9 bibliografia
- Termodinámica:
La termodinámica (del griego θερμo, termo, que significa «calor»1 y δύναμις, dínamis, que significa «fuerza»)2 es la rama de la física que describe los estados de equilibrio a nivel macroscópico. Constituye una teoría fenomenológica, a partir derazonamientos deductivos, que estudia sistemas reales, sin modelizar y sigue un método experimental.4 Los estados de equilibrio se estudian y definen por medio de magnitudes extensivas tales como la energía interna, la entropía, el volumen o la composición molar del sistema,5 o por medio de magnitudes no-extensivas derivadas de las anteriores como la temperatura,presión y el potencial químico; otras magnitudes, tales como la imanación, la fuerza electromotriz y las asociadas con la mecánica de los medios continuos en general también pueden tratarse por medio de la termodinámica.
La termodinámica ofrece un aparato formal aplicable únicamente a estados de equilibrio, definidos como aquel estado hacia «el que todo sistema tiende a evolucionar y caracterizado porque en el mismo todas las propiedades del sistema quedan determinadas por factores intrínsecos y no por influencias externas previamente aplicadas». Tales estados terminales de equilibrio son, por definición, independientes del tiempo, y todo el aparato formal de la termodinámica –todas las leyes y variables termodinámicas–, se definen de tal modo que podría decirse que un sistema está en equilibrio si sus propiedades pueden describirse consistentemente empleando la teoría termodinámica. Los estados de equilibrio son necesariamente coherentes con los contornos del sistema y las restricciones a las que esté sometido. Por medio de los cambios producidos en estas restricciones (esto es, al retirar limitaciones tales como impedir la expansión del volumen del sistema, impedir el flujo de calor, etc.), el sistema tenderá a evolucionar de un estado de equilibrio a otro;8 comparando ambos estados de equilibrio, la termodinámica permite estudiar los procesos de intercambio de masa y energía térmica entre sistemas térmicos diferentes.
Principio cero de la termodinámica:
Este principio o ley cero, establece que existe una determinada propiedad denominada temperatura empírica θ, que es común para todos los estados de equilibrio termodinámico que se encuentren en equilibrio mutuo con uno dado.
En palabras llanas: «Si pones en contacto un objeto con menor temperatura con otro con mayor temperatura, ambos evolucionan hasta que sus temperaturas se igualan».
Tiene una gran importancia experimental «pues permite construir instrumentos que midan la temperatura de un sistema» pero no resulta tan importante en el marco teórico de la termodinámica.
El equilibrio termodinámico de un sistema se define como la condición del mismo en el cual las variables empíricas usadas para definir o dar a conocer un estado del sistema (presión, volumen, campo eléctrico, polarización, magnetización, tensión lineal, tensión superficial, coordenadas en el plano x, y) no son dependientes del tiempo. El tiempo es un parámetro cinético, asociado a nivel microscópico; el cual a su vez está dentro de la físico química y no es parámetro debido a que a la termodinámica solo le interesa trabajar con un tiempo inicial y otro final. A dichas variables empíricas (experimentales) de un sistema se las conoce como coordenadas térmicas y dinámicas del sistema.
Este principio fundamental, aún siendo ampliamente aceptado, no fue formulado formalmente hasta después de haberse enunciado las otras tres leyes. De ahí que recibiese el nombre de principio cero.
Primera ley de la termodinámica:
Primera Ley de la Termodinamica
Esta ley se expresa como:
Q= Calor agregado
w= Trabajo efectuado por el sistema
Notar que el signo menos en el lado derecho de la ecuación se debe justamente a que W se define como el trabajo efectuado por el sistema.
Para entender esta ley, es útil imaginar un gas encerrado en un cilindro, una de cuyas tapas es un émbolo móvil y que mediante un mechero podemos agregarle calor. El cambio en la energía interna del gas estará dado por la diferencia entre el calor agregado y el trabajo que el gas hace al levantar el émbolo contra la presión atmosférica.
.
Segunda ley de la termodinámica
Esta ley marca la dirección en la que deben llevarse a cabo los procesos termodinámicos y, por lo tanto, la imposibilidad de que ocurran en el sentido contrario (por ejemplo, que una mancha de tinta dispersada en el agua pueda volver a concentrarse en un pequeño volumen). También establece, en algunos casos, la imposibilidad de convertir completamente toda la energía de un tipo en otro sin pérdidas. De esta forma, la segunda ley impone restricciones para las transferencias de energía que hipotéticamente pudieran llevarse a cabo teniendo en cuenta sólo el primer principio. Esta ley apoya todo su contenido aceptando la existencia de una magnitud física llamada entropía, de tal manera que, para un sistema aislado (que no intercambia materia ni energía con su entorno), la variación de la entropía siempre debe ser mayor que cero.
Debido a esta ley también se tiene que el flujo espontáneo de calor siempre es unidireccional, desde los cuerpos de mayor temperatura hacia los de menor temperatura, hasta lograr un equilibrio térmico.
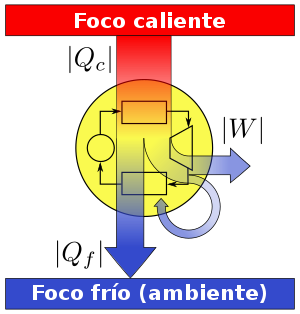
La aplicación más conocida es la de las máquinas térmicas, que obtienen trabajo mecánico mediante aporte de calor de una fuente o foco caliente, para ceder parte de este calor a la fuente o foco o sumidero frío. La diferencia entre los dos calores tiene su equivalente en el trabajo mecánico obtenido.
Existen numerosos enunciados equivalentes para definir este principio, destacándose el de Clausius y el de Kelvin.
Enunciado de Clausius
En palabras de Sears es: «No es posible ningún proceso cuyo único resultado sea la extracción de calor de un recipiente a una cierta temperatura y la absorción de una cantidad igual de calor por un recipiente a temperatura más elevada».
Enunciado de Kelvin—Planck
Es imposible construir una máquina térmica que, operando en un ciclo, no produzca otro efecto que la absorción de energía desde un depósito, con la realización de una cantidad igual de trabajo.
Otra interpretación
Es imposible construir una máquina térmica cíclica que transforme calor en trabajo sin aumentar la energía termodinámica del ambiente. Debido a esto podemos concluir, que el rendimiento energético de una máquina térmica cíclica que convierte calor en trabajo, siempre será menor a la unidad, y ésta estará más próxima a la unidad, cuanto mayor sea el rendimiento energético de la misma. Es decir, cuanto mayor sea el rendimiento energético de una máquina térmica, menor será el impacto en el ambiente, y viceversa.
Tercera ley de la termodinámica:
Algunas fuentes se refieren incorrectamente al postulado de Nernst como "la tercera de las leyes de la termodinámica". Es importante reconocer que no es una noción exigida por la termodinámica clásica por lo que resulta inapropiado tratarlo de «ley», siendo incluso inconsistente con la mecánica estadística clásica y necesitando el establecimiento previo de la estadística cuántica para ser valorado adecuadamente. La mayor parte de la termodinámica no requiere la utilización de este postulado.13El postulado de Nernst, llamado así por ser propuesto por Walther Nernst, afirma que es imposible alcanzar una temperatura igual al cero absoluto mediante un número finito de procesos físicos. Puede formularse también como que a medida que un sistema dado se aproxima al cero absoluto, su entropía tiende a un valor constante específico. La entropía de los sólidos cristalinos puros puede considerarse cero bajo temperaturas iguales al cero absoluto.
Es importante remarcar que los principios o leyes de la termodinámica son válidas siempre para los sistemas macroscópicos, pero inaplicables a nivel microscópico. La idea del demonio de Maxwell ayuda a comprender los límites de la segunda ley de la termodinámica jugando con las propiedades microscópicas de las partículas que componen un gas.
Sistema:
Se puede definir un sistema como un conjunto de materia, que está limitado por una superficie, que le pone el observador, real o imaginaria. Si en el sistema no entra ni sale materia, se dice que se trata de un sistema cerrado, o sistema aislado si no hay intercambio de materia y energía, dependiendo del caso. En la naturaleza, encontrar un sistema estrictamente aislado es, por lo que sabemos, imposible, pero podemos hacer aproximaciones. Un sistema del que sale y/o entra materia, recibe el nombre de abierto. Ponemos unos ejemplos:
- Un sistema abierto: se da cuando existe un intercambio de masa y de energía con los alrededores; es por ejemplo, un coche. Le echamos combustible y él desprende diferentes gases y calor.
- Un sistema cerrado: se da cuando no existe un intercambio de masa con el medio circundante, sólo se puede dar un intercambio de energía; un reloj de cuerda, no introducimos ni sacamos materia de él. Solo precisa un aporte de energía que emplea para medir el tiempo.
- Un sistema aislado: se da cuando no existe el intercambio ni de masa y energía con los alrededores; ¿Cómo encontrarlo si no podemos interactuar con él?Sin embargo un termo lleno de comida caliente es una aproximación, ya que el envase no permite el intercambio de materia e intenta impedir que la energía (calor) salga de él. El universo es un sistema aislado, ya que la variación de energía es cero
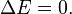
Medio externo:
Se llama medio externo o ambiente a todo aquello que no está en el sistema pero que puede influir en él. Por ejemplo, consideremos una taza con agua, que está siendo calentada por un mechero. Consideremos un sistema formado por la taza y el agua, entonces el medio está formado por el mechero, el aire, etc.
Equilibrio térmico
Toda sustancia por encima de los 0 kelvin (-273,15 °C) emite calor. Si dos sustancias en contacto se encuentran a diferente temperatura, una de ellas emitirá más calor y calentará a la más fría. El equilibrio térmico se alcanza cuando ambas emiten, y reciben la misma cantidad de calor, lo que iguala su temperatura.
- Nota: estrictamente sería la misma cantidad de calor por gramo, ya que una mayor cantidad de sustancia emite más calor a la misma temperatura.
Variables termodinámicas
Las variables que tienen relación con el estado interno de un sistema, se llaman variables termodinámicas o coordenadas termodinámicas, y entre ellas las más importantes en el estudio de la termodinámica son:
- la masa
- el volumen
- la densidad
- la presión
- la temperatura
En termodinámica es muy importante estudiar sus propiedades, las cuáles podemos dividirlas en dos:
- propiedades intensivas: son aquellas que no dependen de la cantidad de sustancia o del tamaño de un sistema, por lo que su valor permanece inalterado al subdividir el sistema inicial en varios subsistemas, por este motivo no son propiedades aditivas.
- propiedades extensivas: son las que dependen de la cantidad de sustancia del sistema, y son recíprocamente equivalentes a las intensivas. Una propiedad extensiva depende por tanto del «tamaño» del sistema. Una propiedad extensiva tiene la propiedad de ser aditiva en el sentido de que si se divide el sistema en dos o más partes, el valor de la magnitud extensiva para el sistema completo es la suma de los valores de dicha magnitud para cada una de las partes.
Algunos ejemplos de propiedades extensivas son la masa, el volumen, el peso, cantidad de sustancia, energía, entropía, entalpía, etc. En general el cociente entre dos magnitudes extensivas nos da una magnitud intensiva, por ejemplo la división entre masa y volumen nos da la densidad.
Estado de un sistema
Un sistema que puede describirse en función de coordenadas termodinámicas se llama sistema termodinámico y la situación en la que se encuentra definido por dichas coordenadas se llama estado del sistema.
Equilibrio térmico
Un estado en el cual dos coordenadas termodinámicas independientes X y Y permanecen constantes mientras no se modifican las condiciones externas se dice que se encuentra en equilibrio térmico. Si dos sistemas se encuentran en equilibrio térmico se dice que tienen la misma temperatura. Entonces se puede definir la temperatura como una propiedad que permite determinar si un sistema se encuentra o no en equilibrio térmico con otro sistema.
El equilibrio térmico se presenta cuando dos cuerpos con temperaturas diferentes se ponen en contacto, y el que tiene mayor temperatura cede energía térmica en forma de calor al que tiene más baja, hasta que ambos alcanzan la misma temperatura.
Algunas definiciones útiles en termodinámica son las siguientes.
Foco térmico
Un foco térmico es un sistema que puede entregar y/o recibir calor, pero sin cambiar su temperatura.
Contacto térmico
Se dice que dos sistemas están en contacto térmico cuando puede haber transferencia de calor de un sistema a otro.
Procesos termodinámicos:
Se dice que un sistema pasa por un proceso termodinámico, o transformación termodinámica, cuando al menos una de las coordenadas termodinámicas no cambia. Los procesos más importantes son:
- Procesos isotérmicos: son procesos en los que la temperatura no cambia.
- Procesos isobáricos: son procesos en los cuales la presión no varía.
- Procesos isócoros: son procesos en los que el volumen permanece constante.
- Procesos adiabáticos: son procesos en los que no hay transferencia de calor alguna.
- Procesos diatérmicos: son procesos que dejan pasar el calor fácilmente.
- Procesos isoentrópicos: procesos adiabáticos y reversibles. Procesos en los que la entropía no varía.
Por ejemplo, dentro de un termo donde se colocan agua caliente y cubos de hielo, ocurre un proceso adiabático, ya que el agua caliente se empezará a enfriar debido al hielo, y al mismo tiempo el hielo se empezará a derretir hasta que ambos estén en equilibrio térmico, sin embargo no hubo transferencia de calor del exterior del termo al interior por lo que se trata de un proceso adiabático.
Rendimiento termodinámico o eficiencia:
Un concepto importante en la ingeniería térmica es el de rendimiento. El rendimiento de una máquina térmica se define como:
donde, dependiendo del tipo de máquina térmica, estas energías serán el calor o el trabajo que se transfieran en determinados subsistemas de la máquina.
Teorema de Carnot:
Nicolas Léonard Sadi Carnot en 1824 demostró que el rendimiento de alguna máquina térmica que tuviese la máxima eficiencia posible (a las que en la actualidad se denotan con su nombre) y que operase entre dos termostatos (focos con temperatura constante), dependería sólo de las temperaturas de dichos focos. Por ejemplo, el rendimiento para un motor térmico de Carnot viene dado por:
donde 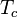 y
y 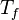 son las temperaturas del termostato caliente y del termostato frío, respectivamente, medidas en Kelvin.
son las temperaturas del termostato caliente y del termostato frío, respectivamente, medidas en Kelvin.
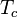 y
y 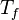 son las temperaturas del termostato caliente y del termostato frío, respectivamente, medidas en Kelvin.
son las temperaturas del termostato caliente y del termostato frío, respectivamente, medidas en Kelvin.
Este rendimiento máximo es el correspondiente al de una máquina térmica reversible, la cual es sólo una idealización, por lo que cualquier máquina térmica construida tendrá un rendimiento menor que el de una máquina reversible operando entre los mismos focos.
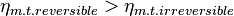
Transformaciones
La energía interna U del sistema depende únicamente del estado del sistema, en un gas ideal depende solamente de su temperatura. Mientras que la transferencia de calor o el trabajo mecánico dependen del tipo de transformación o camino seguido para ir del estado inicial al final.Isócora o a volumen constante
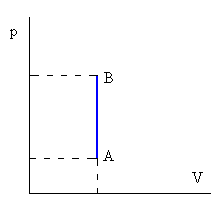
No hay variación de volumen del gas, luegoW=0
Q=ncV(TB-TA)Donde cV es el calor específico a volumen constanteIsóbara o a presión constante
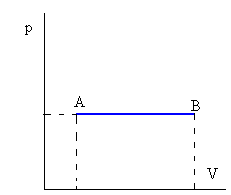 W=p(vB-vA)Q=ncP(TB-TA)Donde cP es el calor específico a presión constante
W=p(vB-vA)Q=ncP(TB-TA)Donde cP es el calor específico a presión constante
CONCLUSIONES:
LA TERMODINAMICA:Comprendimos que la termodinámica se utiliza día a día en nuestras vidas por eso es muy importante, la importancia de estos procesos termodinámicos en nuestro entorno y como estos afectan el medio en que vivimos y de allí presentar alternativas de mejoramiento en la conservación del ambiente.CALOR Y TEMPERATURA:Comprendemos que la temperatura no es energía sino una medida de esta y que es la sensación de la diferencia de calor de los diferentes cuerpos.El calor es lo que hace que la temperatura aumente o disminuya así mismo comprendemos que el calor es una transferencia ente dos cuerpos que se puede asociar al movimiento de los átomosLEYES DE LA TERMODINAMICA:Comprendimos y analizamos las dos leyes de la termodinámica que ocupamos día a día en nuestras vidas manejo de la primera ley que nos habla de la ley de la conservación de la energía, y la segunda ley de la entropía nos suena extraño pero a lo largo de lectura y comprensión vimos que es un sistema cerrado y que no esté en equilibrio, que tiende a aumentar con el tiempo, hasta alcanzar el equilibrio.#include<iostream>
#include<math.h>
using namespace std;
int main()
{
int opcion;
cout<<"********* MENU DE TERMODINAMICA ********* \n\n";
cout<<" 1) PRIMERA LEY DE TERMODINAMICA \n";
cout<<" 2) RENDIMIENTO TERMICO \n";
cout<<" 3) CALOR GANADO \n";
cout<<" 4) TRANSFERENCIA DE CALOR \n";
cout<<"*****************************************\n\n";
cout<<" Ingrese una opcion: "; cin>>opcion;
cout<<endl; cout<<endl;
switch (opcion)
{
case 1:
{
float E,Q,W;
cout<<"********PRIMERA LEY DE TERMODINAMICA********** \n\n";
cout<<"INTRODUCE CAMBIO EN LA ENERGIA INTERNA EN EL SISTEMA:"<<endl;
cin>>E;
cout<<"INTRODUCE EL CALOR AGREGADO:"<<endl;
cin>>Q;
cout<<"INTRODUCE EL TRABAJO EFECTUADO EN EL SISTEMA:"<<endl;
cin>>W;
E = Q - W ;
cout<<"EL CAMBIO EN LA ENERGIA INTERNA EN EL SISTEMA ES = " <<E <<endl;
cout<<" EL CALOR AGREGADO ES = " <<Q <<endl;
cout<<" EL TRABAJO EFECTUADO EN EL SISTEMA ES = " <<W <<endl;
}
break;
case 2:
{
float N,Es,Ee;
cout<<"**********REDIMIENTO TERMICO********** \n\n";
cout<<"INTRODUCE REDIMIENTO TERMICO:"<<endl;
cin>>N;
cout<<"INTRODUCE LA ENERGIA DE ENTRADA:"<<endl;
cin>>Es;
cout<<"INTRODUCE LA ENERGIA DE SALIDA:"<<endl;
cin>>Ee;
N = Es / Ee;
cout<<" EL REDIMIENTO TERMICO ES = " <<N <<endl;
cout<<" LA ENERGIA DE ENTRADA ES = " <<Ee <<endl;
cout<<" LA ENERGIA DE SALIDA ES = " <<Es <<endl;
}
break;
case 3:
{
float Nmc,Tf,Tc;
cout<<"*********LA MAXIMA EFICIENCIA********** \n\n";
cout<<"INTRODUCE LA MAXIMA EFICIENCIA:"<<endl;
cin>>Nmc;
cout<<"INTRODUCE LA TEMPERATURA FINAL:"<<endl;
cin>>Tf;
cout<<"INTRODUCE LA TEMPERATURA CONSTANTE:"<<endl;
cin>>Tc;
Nmc = 1- Tf / Tc;
cout<<" LA LA MAXIMA EFICIENCIA ES = " <<Nmc<<endl;
cout<<" LA TEMPERATURA FINAL ES = " <<Tf<<endl;
cout<<" LA TEMPERATURA CONSTANTE ES = " <<Tc<<endl;
}
break;
case 4:
{
float Q, ncp, TB, TA;
cout<<"********EL CALOR GANADO************ \n\n";
cout<<"INTRODUCE EL CALOR GANADO:"<<endl;
cin>>Q;
cout<<"INTRODUCE EL CALOR ESPECIFICO:"<<endl;
cin>>ncp;
cout<<"INTRODUCE EL TEMPERATURA EN B:"<<endl;
cin>>TB;
cout<<"INTRODUCE EL TEMPERATURA EN A:"<<endl;
cin>>TA;
Q = ncp*(TB-TA);
cout<<" EL CALOR GANADO ES = " <<Q<<endl;
cout<<" EL CALOR ESPECIFICO ES = " <<ncp<<endl;
cout<<" EL TEMPERATURA EN B ES = " <<TB<<endl;
cout<<" EL TEMPERATURA EN A ES = " <<TA<<endl;
}
break;
}//FIN DEL SWITCH
cout<<endl; cout<<"\n";
return 0;
}
https://drive.google.com/file/d/0B-hbvlhBoyyRdzgyYkxWangyQ0k/view?usp=sharing



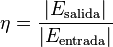
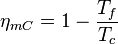
No hay comentarios:
Publicar un comentario